Maturação e germinação de embriões somáticos de goiaba var. Anã Vermelha Cubana EEE-1840
Resumo
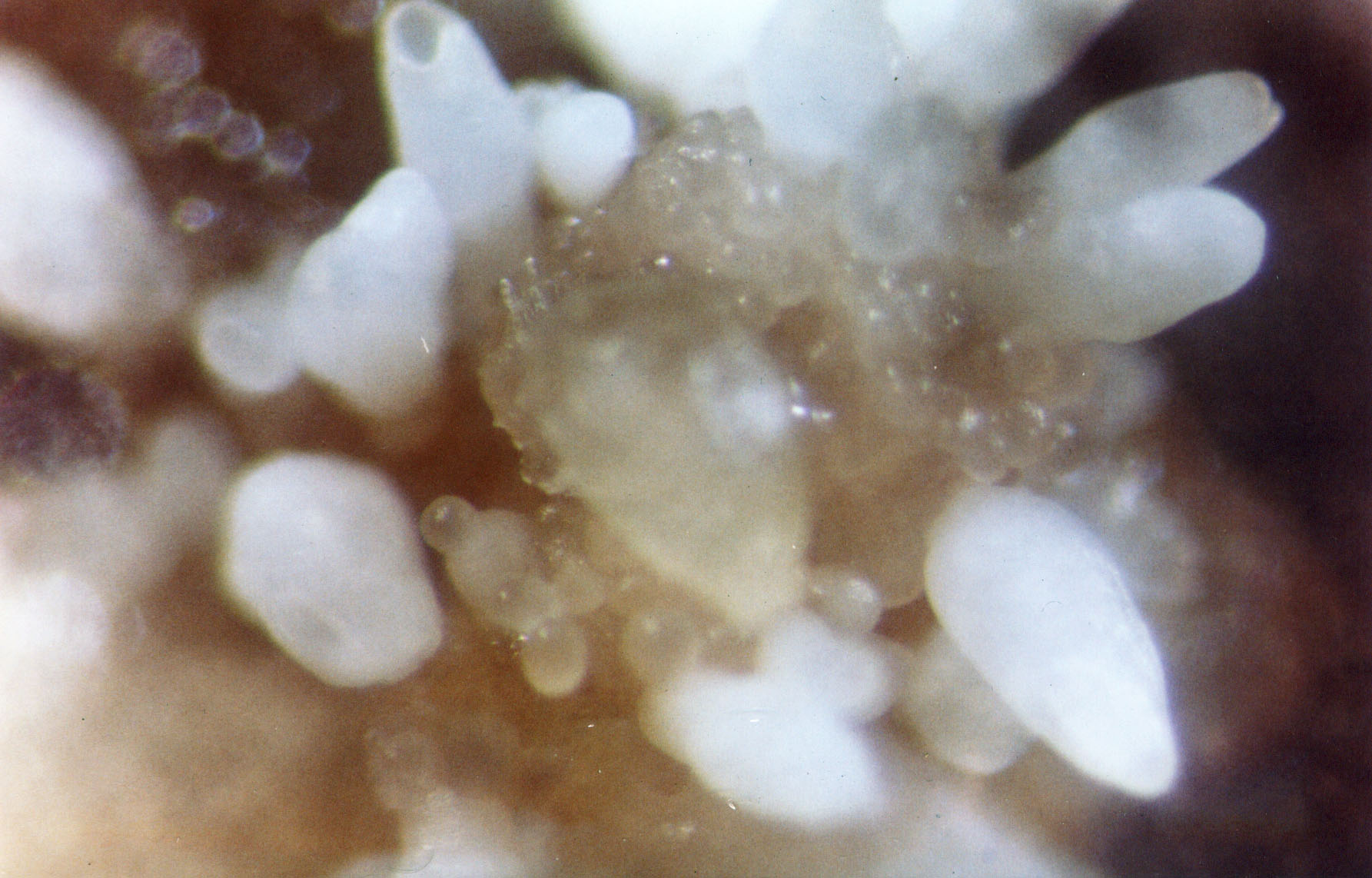
A embriogênese somática é uma alternativa para a propagação acelerada de materiais promissores de goiabeira (Psidium guajava L.) de interesse agronômico. No entanto, as baixas taxas de maturação e germinação dos embriões somáticos são alguns dos aspectos que limitam sua aplicação em programas de melhoramento para diferentes finalidades. Neste sentido, estudou-se o efeito de três concentrações (0, 1 e 1,5 mg.L-1) de ácido abscísico (ABA) na maturação embrionária e de duas concentrações de sacarose (3 e 5 %) e dos macronutrientes Murashige e Skoog (MS) (50 e 100 %) na germinação de embriões somáticos de goiabeira var. Anã Vermelha Cubana EEE-1840. Após seis semanas de cultura, o ABA teve um efeito negativo na maturação de embriões somáticos em meios de cultura suplementados com 1 ou 1,5 mg.L-1, enquanto foram observados embriões 3,95 a 5,49 vezes mais maduros na ausência de ABA. A germinação de embriões somáticos foi significativamente melhorada quando a concentração de macronutrientes no meio de cultura foi reduzida, independentemente da concentração de sacarose [MS 50 % + 3 % de sacarose (73,3 %) e MS 50 % + 5 % de sacarose (55,0 %)]. Conclui-se que a simplificação do meio de cultura com redução dos macroelementos MS e sacarose para a concentração padrão favorece a germinação de embriões maduros de goiabeira var. Anã Vermelha Cubana EEE-1840.
Downloads
Referências
Canhoto, J. M., Lopes, M. L., & Cruz, G. S. (1999). Somatic embryogenesis and plant regeneration in myrtle (Myrtaceae). In Plant Cell, Tissue and Organ Culture, 57, 13-21. https://doi.org/10.1023/A:1006273128228
Choi, Y.E., & Jeong, J.H. (2002). Dormancy induction of somatic embryos of Siberian ginseng by high sucrose concentrations enhances the conservation of hydrated artificial seeds and dehydration resistance. Plant Cell Reports, 20, 1112–1116. https://doi.org/10.1007/s00299-002-0455-y
Cipriano, J. L., Cruz, A. C. F., Mancini, K. C., Schmildt, E. R., Lopes, J. C., Otoni, W. C., & Alexandre, R. S. (2018). Somatic embryogenesis in Carica papaya as affected by auxins and explants, and morphoanatomical-related aspects. Anais da Academia Brasileira de Ciências, 90, 385-400. https://doi.org/10.1590/0001-3765201820160252
Corredoira, E., Ballester, A., & Vieitez, A. M. (2003). Proliferation, maturation and germination of Castanea sativa Mill. somatic embryos originated from leaf explants. Annals of Botany, 92(1), 129–136. https://doi.org/10.1093/aob/mcg107
Cruz G.S., Canhoto J. M., & Abreu M. (1990). Somatic embryogenesis and plant regeneration from zygotic embryos of Feijoa sellowiana Berg. Plant Science 66, 263-270. https://doi.org/10.1016/0168-9452(90)90212-7
do Nascimento, A. M. M., Polesi, L. G., Back, F. P., Steiner, N., Guerra, M. P., Castander-Olarieta, A., Moncaleán, P., & Montalbán, I. A. (2021). The Chemical Environment at Maturation Stage in Pinus spp. Somatic Embryogenesis: Implications in the Polyamine Profile of Somatic Embryos and Morphological Characteristics of the Developed Plantlets. Frontiers in Plant Science, 12, 771464. https://doi.org/10.3389/fpls.2021.771464
Gao, F., Peng, C., Wang, H., Shen, H., & Yang, L. (2021). Selection of culture conditions for callus induction and proliferation by somatic embryogenesis of Pinus koraiensis. Journal of Forestry Research, 32(2), 483–491. https://doi.org/10.1007/s11676-020-01147-1
George, E.F., Hall, M.A., & Klerk, G.J.D. (2008). Somatic Embryogenesis. In: George, E.F., Hall, M.A. & Klerk, G.J.D. (eds). Plant Propagation by Tissue Culture. Springer, Dordrecht. https://doi.org/10.1007/978-1-4020-5005-3_9
Gómez R. (1998). Embriogénesis Somática. En: Propagación y mejora genética de plantas por biotecnología. pp13-22. Pérez J. (eds). Primera edición. Instituto de Biotecnología de las Plantas. Universidad Central de las Villas. Santa Clara. Cuba.
Gómez, R., Vilchez-Perozo, J., Albany, N., & Agramonte, D. (2005). Somatic embryo germination of Psidium guajava L. in the Rita® temporary immersion system and on semisolid medium. In: Hvoslef-Eide, A.K., Preil, W. (eds). Liquid Culture Systems for in vitro Plant Propagation. Springer, Dordrecht. https://doi.org/10.1007/1-4020-3200-5_14
González, Jiménez, M. C., & Olivet, E. (2023). Respuesta agronómica del cultivo de la guayaba (Psidium guajava. L) a la aplicación del Quitomax®. Revista Científica Agroecosistemas, 11(1), 163-171. https://aes.ucf.edu.cu/index.php/aes/article/view/612
Gray, D.J. (1987). Quiescence in monocotyledonous and dicotyledonous somatic embryos induced by dehydration. Hortscience, 22, 810–814. https://doi.org/10.21273/HORTSCI.22.5.810
Guan, Y., Li, S. G., Fan, X. F., & Su, Z. H. (2016). Application of somatic embryogenesis in woody plants. Frontiers in Plant Science, 7, 938 https://doi.org/10.3389/fpls.2016.00938
Kaur K., Dolker D., Behera S., & Pati P.K. (2022). Critical factors influencing in vitro propagation and modulation of important secondary metabolites in Withania somnifera (L.) Dunal. Plant Cell, Tissue and Organ Culture, 149, 41-60. https://doi.org/10.1007/s11240-021-02225-w
Kubeš, M., Drážná, N., Konrádová, H., & Lipavská, H. (2014). Robust carbohydrate dynamics based on sucrose resynthesis in developing Norway spruce somatic embryos at variable sugar supply. In Vitro Cellular and Developmental Biology-Plant, 50, 45-57. https://doi.org/10.1007/s11627-013-9589-6
Litz R.E. (1984a). In vitro somatic embryogenesis from callus of Jaboticaba, Myrciaria cauliflora. HortScience, 19(1), 62-64. https://doi.org/10.21273/HORTSCI.19.1.62
Litz R.E. (1984b). In vitro responses of adventitious embryos of two polyembrionic Eugenia species. HortScience, 19(5), 720-722. https://doi.org/10.21273/HORTSCI.19.5.720
Mazri, M. A., Naciri, R., & Belkoura, I. (2020). Maturation and conversion of somatic embryos derived from seeds of olive (Olea europaea L.) cv. Dahbia: occurrence of secondary embryogenesis and adventitious bud formation. Plants 2020, 9(11), 1489; https://doi.org/10.3390/plants9111489.
Murashige, T., & Skoog F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia plantarum, 15(3), 473-497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
Oliveira, F. L. R., Sant’anna-Santos, B. F., Fraga, H. P., Degenhardt, J., & Quoirin, M. (2022). Embryogenic cultures and somatic embryos development from mature seeds of jabuticaba (Plinia cauliflora (Mart.) Kausel). Anais da Academia Brasileira de Ciências, 94(4): e20201073. https://doi.org/10.1590/0001-3765202220201073
Perán-Quesada, R., Sánchez-Romero, C., Barceló-Muñoz, A., & Pliego-Alfaro, F. (2004). Factors affecting maturation of avocado somatic embryos. Scientia Horticulturae, 102(1), 61–73. https://doi.org/10.1016/j.scienta.2003.12.003
Rai, M. K., Akhtar, N., & Jaiswal, V. S. (2007). Somatic embryogenesis and plant regeneration in Psidium guajava L. cv. Banarasi local. Scientia Horticulturae, 113(2), 129–133. https://doi.org/10.1016/j.scienta.2007.02.010
Rai, M. K., Jaiswal, V. S., & Jaiswal, U. (2008). Effect of ABA and sucrose on germination of encapsulated somatic embryos of guava (Psidium guajava L.). Scientia Horticulturae, 117(3), 302–305. https://doi.org/10.1016/j.scienta.2008.04.011
Ramos, L., Juan, N., Daza, A., Acosta, J. L., Cisneros, F. G., Tamayo Aguilar, Y., Hidalgo, E. C., Trejo, S. L., & Rodríguez-Ortiz, G. (2013). Pectimorf ® dose for rooting from cuttings of guava variety Cuban Red Dwarf. Revista Mexicana de Ciencias Agrícolas, (6), 1093-1105. http://www.scielo.org.mx/pdf/remexca/v4nspe6/v4spe6a2.pdf
Rezende, J.C., Carvalho C.H.S., Pascual M., Santos A.C.R., & Carvalho SM. (2011). Calli induction in leaf explants of coffee elite genotypes. Ciência Rural, 41, 384-389. https://doi.org/10.1590/S0103-84782011000300004
Riviello-Cogco, E., Robledo-Paz, A., Gutiérrez-Espinosa, M. A., Suárez-Espinosa, J., & Mascorro-Gallardo, J. O. (2021). Maduración y germinación de embriones somáticos de Coffea arabica cv. Colombia. Revista Fitotecnia Mexicana, 44(2), 161-161. https://doi.org/10.35196/rfm.2021.2.161
Rong, Y., Junduo L., Ningbo Z., Qinhan Y., & Weirong X. (2023). Phenotypically abnormal cotyledonary Vitis vinifera embryos differ in anatomy, endogenous hormone levels and transcriptome profiles. Tree Physiology, (43),3, 467–485, https://doi.org/10.1093/treephys/tpac129
Shohael, A., Khatun S., Alam M., & Paek K. (2013). Effects of Murashige and Skoog medium strength on germination and secondary metabolites production of Eleutherococcus senticosus somatic embryos in bioreactor. International Journal of Biosciences, 3, 155-163. http://dx.doi.org/10.12692/ijb/3.3.155-163
Sokal, R. & Rohlf, F. (2013). Biometry: The Principles and Practice of Statistics in Biological Research. W.H. Freeman and Company, New York.
Statistix 8. (2003). Statistix 8: Analytical Software User’s Manual. Tallahassee, Florida, U.S.A.
Stuart, D. A., & Strickland, S. G. (1984). The role of aminoacid additions to the regeneration medium. Plant Science Letters, 34, 74-81. https://doi.org/10.1016/0304-4211(84)90139-1
Vahdati, K., Bayat, S., Ebrahimzadeh, H., Jariteh, M., & Mirmasoumi, M. (2008). Effect of exogenous ABA on somatic embryo maturation and germination in Persian walnut (Juglans regia L.). Plant Cell, Tissue and Organ Culture, 93(2), 163–171. https://doi.org/10.1007/s11240-008-9355-3
Vilchez-Perozo J., Albany N., Gómez-Kosky R., & García L. (2002). Inducción de embriogénesis somática en Psidium guajava L. a partir de embriones cigóticos. Revista de la Facultad de Agronomía (LUZ), 19(4): 284-293. https://produccioncientificaluz.org/index.php/agronomia/article/view/26429/27055
Direitos de Autor (c) 2023 Jorge Vilchez-Perozo, Nilca Albany Valero, Fernando Pliego Alfaro, Carolina Sánchez Romero

This work is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.


















