Caracterización molecular e identificación de Shewanella putrefaciens y aislamiento y caracterización morfológica de su fagolítico
Resumen
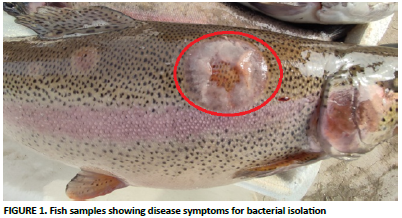
Hasta la década de 1990, los estudios sobre bacterias aisla- das mediante los métodos de diagnóstico tradicionales, que se han empleado durante muchos años para la detección de patógenos en la acuicultura, se limitaban a 15-20 especies bac- terianas. Por el contrario, el número de bacterias identificadas ha llegado a 70 mediante el uso de la secuenciación del 16S rDNA, que se ha identificado como el estándar de oro para la identificación en los últimos años. Shewanella putrefaciens es una bacteria patogénica que fue aislada de peces marinos en agua dulce. El número de informes sobre Shewanella putrefa- ciens ha aumentado notablemente con la aplicación de este método, y se ha identificado como un patógeno oportunista en la acuicultura. En este estudio, la bacteria Shewanella putre- faciens se aisló de la trucha arcoíris (Oncorhynchus mykiss) en jaulas en el lago de la presa Karkamış y se identificó mediante el uso de la secuenciación del rDNA 16S. Además, los fagos lí- ticos de esta bacteria se aislaron del mismo lago de la presa y se visualizaron mediante microscopía electrónica de emisión de campo. Se determinó que los fagos obtenidos exhibían una estructura de cabeza icosaédrica, carecían de cola y tenían una longitud de aproximadamente 50-60 nm. Uno de los factores principales que influyen en la eficacia de los estudios de tera- pia con fagos es la prevalencia de patógenos oportunistas. Este estudio demostró que los fagos líticos del patógeno oportu- nista Shewanella putrefaciens, del que se ha informado cada vez más en los últimos años, pueden tener el potencial de ser utilizados en modelos de terapia con fagos.
Descargas
Citas
Buller NB. Bacteria and fungi from fish and other aquatic animals: a practical identification manual. 2nd ed. Pondirechi, India. CAB Internacional. 2014; 863 p. DOI: https://doi.org/10.1079/9781845938055.0000
Qin L, Zhu M, Xu J. First report of Shewanella sp. and Listonella sp. infection in freshwater cultured loach, Misgurnus anguillicaudatus. Aquac. Res. [Internet]. 2014; 45(4):602-608. doi: https://doi.org/f537n3 DOI: https://doi.org/10.1111/j.1365-2109.2012.03260.x
Paździor E. Shewanella putrefaciens–a new opportunistic pathogen of freshwater fish. J. Vet. Res. [Internet]. 2016; 60(4):429-434. doi: https://doi.org/n4p2 DOI: https://doi.org/10.1515/jvetres-2016-0064
Pękala A, Kozińska A, Paździor E, Głowacka H. Phenotypical and genotypical characterization of Shewanella putrefaciens strains isolated from diseased freshwater fish. J. Fish Dis. [Internet]. 2015; 38(3):283-293. doi https://doi. org/f66pkb DOI: https://doi.org/10.1111/jfd.12231
Qin L, Zhang X, Bi K. A new pathogen of gibel carp Carassius auratus gibelio-Shewanella putrefaciens. Wei Sheng Wu Xue Bao. [Internet]. 2012; 52(5):558-565. Available in: https://n9.cl/ako31
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/ NT. Nucleic Acids Symp. Ser. 1999; 41(41): 95-98. Available in https://n9.cl/0uzc7
Van-Twest R, Kropinski AM. Bacteriophage enrichment from water and soil. Methods Mol Biol. [Internet]. 2009; 5011:15-21. doi: https://doi.org/d5v7t6 DOI: https://doi.org/10.1007/978-1-60327-164-6_2
Xu Z. Isolation, Characterisation and Application of Bacteriophages in Aquaculture. [Doctoral Thesis on the Internet]. Santander: University of Stirling; 2016. [Cited 10 Sep 2024]. 163 p. Available in: https://n9.cl/fu3xo
Kropinski AM, Mazzocco A, Waddell TE, Lingohr E, Johnson RP. Enumeration of Bacteriophages by Double Agar Overlay Plaque Assay Methods Mol Biol. [Internet]. 2009; 501:97-112. doi: https://doi.org/fhnswx DOI: https://doi.org/10.1007/978-1-60327-164-6_7
Sambrook J, Russel DW. Molecular Cloning. In: Green MR, Sambrook J, editor. A Laboratory Manual. Cold Spring Harbor Laboratory Press New York; 2001. p. 31-41.
Ackermann HW. Phage classification and characterization. Methods Mol. Biol. [Internet]. 2009; 501:127-140. doi: https://doi.org/cb86cz DOI: https://doi.org/10.1007/978-1-60327-164-6_13
Mohammed HH, Peatman E. Winter kill in intensively stocked channel catfish (Ictalurus punctatus): Coinfection with Aeromonas veronii, Streptococcus parauberis and Shewanella putrefaciens. J. Fish Dis. [Internet]. 2018; 41(9):1339-1347. doi: https://doi.org/gd4bdd DOI: https://doi.org/10.1111/jfd.12827
Goldschmidt-Clermont E, Wahli T, Frey J, Burr SE. Identification of bacteria from the normal flora of perch, Perca fluviatilis L., and evaluation of their inhibitory potential towards Aeromonas species. J. Fish. Dis. [Internet]. 2008; 31(5):353-359. doi: https://doi.org/dj9znv DOI: https://doi.org/10.1111/j.1365-2761.2008.00912.x
Kayış Ş, Düzgün A, Er A. Bacterial and Parasitic Pathogens Isolated from Some Wild Cyprinid Fishes. El-Cezeri. [Internet]. 2018; 5(3):763-772. doi: https://doi.org/n4p3 DOI: https://doi.org/10.31202/ecjse.422568
Şık Z, Altıntaş Ö, Atıcı EG. Bacterial agents isolated from fish: A five year evaluation. Etlik Journal of Veterinary Microbiology. [Internet]. 2020; 31(1):29-33. doi: https://doi.org/n4p4 DOI: https://doi.org/10.35864/evmd.708034
Yang ZQ, Tao XY, Zhang H, Rao SQ, Gao L, Pan ZM, Jiao XA. Isolation and characterization of virulent phages infecting Shewanella baltica and Shewanella putrefaciens, and their application for biopreservation of chilled channel catfish (Ictalurus punctatus). Int. J. Food Microbiol. [Internet]. 2019; 292:107-117. doi: https://doi.org/n4p5 DOI: https://doi.org/10.1016/j.ijfoodmicro.2018.12.020
Liu X, Tang K, Zhang D, Li Y, Liu Z, Yao J, Wood TK, Wang X. Symbiosis of a P2-family phage and deep-sea Shewanella putrefaciens. Environ. Microbiol. [Internet]. 2019;21(11):4212-4232. doi: https://doi.org/n4p6 DOI: https://doi.org/10.1111/1462-2920.14781
Leigh B, Karrer C, Cannon JP, Breitbart M, Dishaw LJ. Isolation and Characterization of a Shewanella Phage–Host System from the Gut of the Tunicate, Ciona intestinalis. Viruses. [Internet]. 2017;9(3):60. doi: https://doi.org/n4p7 DOI: https://doi.org/10.3390/v9030060
Laupland KB, Valiquette L. The Changing Culture of the Microbiology Laboratory. Can. J. Infect. Dis. Med. Microbiol. [Internet]. 2013;24(3):125-128. doi: https://doi.org/n4p8 DOI: https://doi.org/10.1155/2013/101630
Sulakvelidze A, Alavidze Z, Morris-Jr JG. Bacteriophage Therapy. Antimicrob. Agents Chemother. [Internet]. 2001; 45(3):649-659. doi: https://doi.org/cdbs59 DOI: https://doi.org/10.1128/AAC.45.3.649-659.2001
Summers WC. Bacteriophage therapy. Annu. Rev. Microbiol. [Internet]. 2001; 55:437-451. doi: https://doi.org/bpfddx DOI: https://doi.org/10.1146/annurev.micro.55.1.437