Evaluación ecográfıca del tórax en perros con parálisis por garrapatas
Resumen
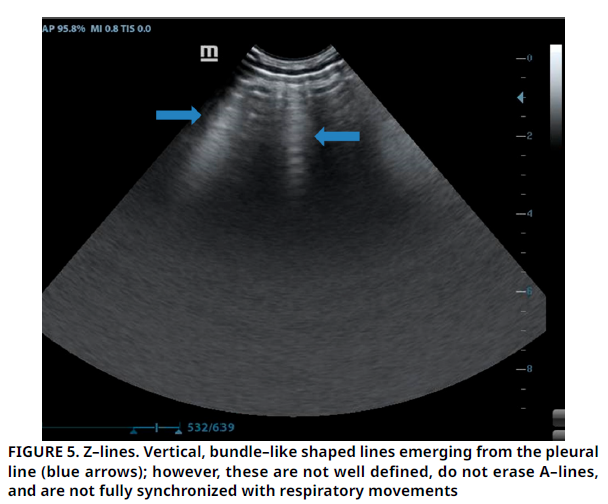
La parálisis por garrapatas es una parálisis motora de rápida progresión causada por una neurotoxina en la saliva de ciertas especies de garrapatas. Un diagnóstico tardío puede llevar a un aumento en la mortalidad debido a insuficiencia respiratoria. Por lo tanto, el objetivo de este estudio fue describir las lesiones detectadas mediante ecografía torácica en perros con parálisis por garrapatas e identificar patrones potenciales que puedan ayudar en el diagnóstico y la predicción del pronóstico. El material animal consistió en un total de 58 perros, 10 de los cuales estaban sanos y 48 se sospechaba que estaban afectados por parálisis por garrapatas. Se realizaron exámenes clínicos, de laboratorio y ecográficos torácicos. Se observó disnea espiratoria con taquicardia sinusal; estertores finos, sibilancias polifónicas y roce pleural en la auscultación pulmonar de los perros paralizados por garrapatas. Los patrones anormales más comunes en la ecografía torácica fueron, en orden de prevalencia: líneas B > 3, pulmón húmedo, nódulo pulmonar, líneas B confluyentes, pérdida de líneas A, consolidación, fibrosis y líneas B aisladas. Además, el grosor pleural de los perros con parálisis por garrapatas fue mayor que el de los sanos. Entre estos hallazgos, las líneas B > 3 se interpretaron como indicativas de posible daño parenquimatoso pulmonar, mientras que la pérdida de líneas A se atribuyó a una disminución de la aireación. La presencia de nódulo pulmonar y fibrosis podría deberse a bronconeumonía y neumonía por aspiración debido a regurgitación. El patrón de pulmón húmedo se asoció con una predisposición a la congestión pulmonar. Se concluyó que el reconocimiento de los hallazgos ecográficos torácicos puede ayudar a identificar la presencia y a clasificar la extensión del daño pulmonar, así como a determinar la necesidad de tratamiento de descongestión pulmonar en casos de parálisis por garrapatas.
Descargas
Citas
Pienaar R, Neitz AWH, Mans BJ. Tick paralysis: solving an enigma. Vet. Sci. [Internet]. 2018; 5(2):53. doi: https://doi.org/g82fh8 DOI: https://doi.org/10.3390/vetsci5020053
Padula AM. Tick paralysis of animals in Australia. In: Vogel CW, Seifert S, Tambourgi D, editors. Clinical toxinology in Australia, Europe, and Americas. Toxinology [Internet]. Dordrecht (Netherlands): Springer; 2018. p. 279-304. doi: https://doi.org/g82fh9 DOI: https://doi.org/10.1007/978-94-017-7438-3_65
Holland CT. Asymmetrical focal neurological deficits in dogs and cats with naturally occurring tick paralysis (Ixodes holocyclus): 27 cases (1999-2006). Aust. Vet. J. [Internet]. 2008; 86(10):377-384. doi: https://doi.org/fgvxp4 DOI: https://doi.org/10.1111/j.1751-0813.2008.00346.x
Ruppin M, Sullivan S, Condon F, Perkins N, Lee L, Jeffcott LB, Dart AJ. Retrospective study of 103 presumed cases of tick (Ixodes holocyclus) envenomation in the horse. Aust. Vet. J. [Internet]. 2012; 90(5):175-180. doi: https://doi.org/g82fjb DOI: https://doi.org/10.1111/j.1751-0813.2012.00916.x
Ilkiw JE, Turner DM, Howlett CR. Infestation in the dog by the paralysis tick Ixodes holocyclus 1. Clinical and histological findings. Aust. Vet. J. [Internet]. 1987; 64(5):137-139. doi: https://doi.org/dfv4gh DOI: https://doi.org/10.1111/j.1751-0813.1987.tb09662.x
Campbell F, Atwell R. Heart failure in dogs with tick paralysis caused by the Australian paralysis tick, Ixodes holocyclus. Int. J. Appl. Res. Vet. Med. [Internet]. 2003 [cited 12 Aug. 2024]; 1(2):148-162. Available in: https://goo.su/tVfJ
Atwell R. Laryngeal paresis caused by I–holocyclus. Aust. Vet. Pract. 2002; 32(1):41-41.
Nazerian P, Volpicelli G, Vanni S, Gigli C, Betti L, Bartolucci M, Zanobetti M, Ermini FR, Iannello C, Grifoni S. Accuracy of lung ultrasound for the diagnosis of consolidations when compared to chest computed tomography. Am. J. Emerg. Med. [Internet]. 2015; 33(5):620-625. doi: https://doi.org/f7b663 DOI: https://doi.org/10.1016/j.ajem.2015.01.035
Touw HR, Tuinman PR, Gelissen HP, Lust E, Elbers PW. Lung ultrasound: routine practice for the next generation of internists. Neth. J. Med. [Internet]. 2015 [cited 12 Aug. 2024]; 73(3):100-107. PMID: 25852109. Available in: https://goo.su/qXtIgdq
Ward JL, Lisciandro GR, Keene BW, Tou SP, DeFrancesco TC. Accuracy of point–of–care lung ultrasonography for the diagnosis of cardiogenic pulmonary edema in dogs and cats with acute dyspnea. J. Am. Vet. Med. Assoc. [Internet]. 2017; 250(6):666-675. doi: https://doi.org/f9xq5r DOI: https://doi.org/10.2460/javma.250.6.666
Lichtenstein DA, Mezière GA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure: the BLUE protocol. CHEST [Internet]. 2008; 134(1):117-125. doi: https://doi.org/cspcds DOI: https://doi.org/10.1378/chest.07-2800
Koenig S, Mayo P, Volpicelli G, Millington SJ. Lung ultrasound scanning for respiratory failure in acutely ill patients: a review. CHEST [Internet]. 2020; 158(6):2511-2516. doi: https://doi.org/gnsr3p DOI: https://doi.org/10.1016/j.chest.2020.08.2052
Marx A, Glass JD, Sutter RW. Differential diagnosis of acute flaccid paralysis and its role in poliomyelitis surveillance. Epidemiol. Rev. [Internet]. 2000; 22(2):298-316. doi: https://doi.org/g82fjc DOI: https://doi.org/10.1093/oxfordjournals.epirev.a018041
Malik R, Farrow BR. Tick paralysis in North America and Australia. Vet. Clin. North. Am. Small. Anim. Pract. [Internet]. 1991; 21(1):157-171. doi: https://doi.org/g82fjd DOI: https://doi.org/10.1016/S0195-5616(91)50016-4
Martinez–Anton L, Marenda M, Firestone SM, Bushell RN, Child G, Hamilton AI, Long SN, Le Chevoir MAR. Investigation of the role of Campylobacter infection in suspected acute polyradiculoneuritis in dogs. J. Vet. Intern. Med. [Internet]. 2018; 32(1):352-360. doi: https://doi.org/gcvs6b DOI: https://doi.org/10.1111/jvim.15030
Cuddon PA. Acquired canine peripheral neuropathies. Vet. Clin. North. Am. Small. Anim. Pract. [Internet]. 2002; 32(1):207-249. doi: https://doi.org/fwjdtf DOI: https://doi.org/10.1016/S0195-5616(03)00086-X
Musteata M, Nicolescu A, Solcan G, Deleanu C. The 1H NMR profile of healthy dog cerebrospinal fluid. PLoS One. [Internet]. 2013; 8(12):e81192. doi: https://doi.org/g82fjf DOI: https://doi.org/10.1371/journal.pone.0081192
Lisciandro GR, Fulton RM, Fosgate GT, Mann KA. Frequency and number of B–lines using a regionally based lung ultrasound examination in cats with radiographically normal lungs compared to cats with left–sided congestive heart failure: J. Vet. Emerg. Crit. Care [Internet]. 2017; 27(5):499-505. doi: https://doi.org/g82fjg DOI: https://doi.org/10.1111/vec.12637
Buda N, Kosiak W, Radzikowska E, Olszewski R, Jassem E, Grabczak EM, Pomiecko A, Piotrkowski J, Piskunowicz M, Sołtysiak M, Skoczyński S, Jaczewski G, Odrowska J, Skoczylas A, Wełnicki M, Wiśniewski J, Zamojska A, Polish Committee on Lung Ultrasound (PC–LUS) for POLLUS–IM. Polish recommendations for lung ultrasound in internal medicine (POLLUS–IM). J. Ultrason. [Internet]. 2018; 18(74):198-206. doi: https://doi.org/gfnpzj
Ward JL, Lisciandro GR, Ware WA, Miles KG, Viall AK, DeFrancesco TC. Lung ultrasonography findings in dogs with various underlying causes of cough. J. Am. Vet. Med. Assoc. [Internet]. 2019; 255(5):574-583. doi: https://doi.org/gjnvmd DOI: https://doi.org/10.2460/javma.255.5.574
Schull DN, O’Leary CA. The use of tick antitoxin serum and associated therapy for the treatment of dogs with Ixodes holocyclus toxicity. Aust. Vet. Pract. 2007; 37(3):90-97.
Wang Y, Watters N, Jones E, Padula A, Leister E, Haworth M, Henning J, Allavena R. Pulmonary histopathology in cats and dogs with fatal tick paralysis. J. Comp. Pathol. [Internet]. 2022; 197:44-52. doi: https://doi.org/g82fjh DOI: https://doi.org/10.1016/j.jcpa.2022.07.005
Hecht S. Thorax. In: Penninck D, D’Anjou MA, editors. Atlas of small animal ultrasonography. Ames (Iowa, USA): Blackwell Publishing; 2008. p. 119-150.
Lichtenstein DA. Lung ultrasound in the critically ill. Ann. Intensive. Care. [Internet]. 2014; 4(1). doi: https://doi.org/gcb3qq DOI: https://doi.org/10.1186/2110-5820-4-1
Saraogi A. Lung ultrasound: present and future. Lung India [Internet]. 2015; 32(3):250-257. doi: https://doi.org/gdwpg5 DOI: https://doi.org/10.4103/0970-2113.156245
Mooney ET, Rozanski EA, King RG, Sharp CR. Spontaneous pneumothorax in 35 cats (2001-2010). J. Feline Med. Surg. [Internet]. 2012; 14(6):384-391. doi: https://doi.org/f3xz8h DOI: https://doi.org/10.1177/1098612X12439947
Luyendyk JP, Schoenecker JG, Flick MJ. The multifaceted role of fibrinogen in tissue injury and inflammation. Blood [Internet]. 2019; 133(6):511-520. doi: https://doi.org/gj4jvh DOI: https://doi.org/10.1182/blood-2018-07-818211
Lisciandro GR, Lagutchik MS, Mann KA, Voges AK, Fosgate GT, Tiller EG, Cabano NR, Bauer LD, Book BP. Evaluation of a thoracic focused assessment with sonography for trauma (TFAST) protocol to detect pneumothorax and concurrent thoracic injury in 145 traumatized dogs. J. Vet. Emerg. Crit. Care [Internet]. 2008; 18(3):258-269. doi: https://doi.org/dkmsjr DOI: https://doi.org/10.1111/j.1476-4431.2008.00312.x
Wongwaisaywan S, Suwannanon R, Sawatmongkorngul S, Kaewlai R. Emergency thoracic US: the essentials. Radiographics [Internet]. 2016; 36(3):640-659. doi: https://doi.org/f8ncv4 DOI: https://doi.org/10.1148/rg.2016150064
Bouhemad B, Zhang M, Lu Q, Rouby JJ. Clinical review: bedside lung ultrasound in critical care practice. Crit. Care. [Internet]. 2007; 11(205). doi: https://doi.org/dnp4xw DOI: https://doi.org/10.1186/cc5668
Volpicelli G. Sonographic diagnosis of pneumothorax. Intensive Care Med. [Internet]. 2011; 37(2):224-232. doi: https://doi.org/c48c93 DOI: https://doi.org/10.1007/s00134-010-2079-y
Via G, Lichtenstein D, Mojoli F, Rodi G, Neri L, Storti E, Klersy C, Iotti G, Braschi A. Whole lung lavage: a unique model for ultrasound assessment of lung aeration changes. Intensive Care Med. [Internet]. 2010; 36(6):999-1007. doi: https://doi.org/dxxkpw DOI: https://doi.org/10.1007/s00134-010-1834-4
Reber A, Engberg G, Wegenius G, Hedenstierna G. Lung aeration: the effect of pre–oxygenation and hyperoxygenation during total intravenous anaesthesia. Anaesthesia. [Internet]. 1996; 51(8):733-737. doi: https://doi.org/cpxk44 DOI: https://doi.org/10.1111/j.1365-2044.1996.tb07885.x
Touw HR, Parlevliet KL, Beerepoot M, Schober P, Vonk A, Twisk JW, Elbers PW, Boer C, Tuinman PR. Lung ultrasound compared with chest X–ray in diagnosing postoperative pulmonary complications following cardiothoracic surgery: a prospective observational study. Anaesthesia [Internet]. 2018; 73(8):946-954. doi: https://doi.org/gdxzkm DOI: https://doi.org/10.1111/anae.14243
Vezzosi T, Mannucci T, Pistoresi A, Toma F, Tognetti R, Zini E, Domenech O, Auriemma E, Citi S. Assessment of lung ultrasound B–lines in dogs with different stages of chronic valvular heart disease. J. Vet. Intern. Med. [Internet]. 2017; 31(3):700-704. doi: https://doi.org/f9xqw2 DOI: https://doi.org/10.1111/jvim.14692
Ward JL, Lisciandro GR, DeFrancesco TC. Distribution of alveolar–interstitial syndrome in dogs and cats with respiratory distress as assessed by lung ultrasound versus thoracic radiographs. J. Vet. Emerg. Crit. Care [Internet]. 2018; 28(5):415-428. doi: https://doi.org/g82fjj DOI: https://doi.org/10.1111/vec.12750
Patel CJ, Bhatt HB, Parikh SN, Jhaveri BN, Puranik JH. Bedside lung ultrasound in emergency protocol as a diagnostic tool in patients of acute respiratory distress presenting to emergency department. J. Emerg. Trauma Shock [Internet]. 2018; 11(2):125-129. doi: https://doi.org/gdr8x3 DOI: https://doi.org/10.4103/JETS.JETS_21_17
Manolescu D, Oancea C, Timar B, Traila D, Malita D, Birsasteanu F, Tudorache V. Ultrasound mapping of lung changes in idiopathic pulmonary fibrosis. Clin. Respir. J. [Internet]. 2020; 14(1):54-63. doi: https://doi.org/g82fjk DOI: https://doi.org/10.1111/crj.13101
Gargani L. Lung ultrasound: a new tool for the cardiologist. Cardiovasc. Ultrasound [Internet]. 2011; 9(6). doi: https://doi.org/dxb4sf DOI: https://doi.org/10.1186/1476-7120-9-6
Raimondi F, Migliaro F, Sodano A, Umbaldo A, Romano A, Vallone G, Capasso L. Can neonatal lung ultrasound monitor fluid clearance and predict the need of respiratory support? Crit. Care [Internet]. 2012; 16(R220). doi: https://doi.org/g82fjm DOI: https://doi.org/10.1186/cc11865
Webster RA. Tick paralysis 1 – pathophysiology, controversies and initial management. Continuing Veterinary Education, Proceedings No 411; 2014:91.
Copley SJ, Wells AU, Rubens MB, Chabat F, Sheehan RE, Musk AW, Hansell DM. Functional consequences of pleural disease evaluated with chest radiography and CT. Radiology [Internet]. 2001; 220(1):237-243. doi: https://doi.org/g8brnf DOI: https://doi.org/10.1148/radiology.220.1.r01jl27237
Chua F, Desai SR, Nicholson AG, Devaraj A, Renzoni E, Rice A, Wells AU. Pleuroparenchymal fibroelastosis: a review of clinical, radiological, and pathological characteristics. Ann. Am. Thorac. Soc. [Internet]. 2019; 16(11):1351-1359. doi: https://doi.org/gngnd6 DOI: https://doi.org/10.1513/AnnalsATS.201902-181CME
Leach HG, Chrobak I, Han R, Trojanowska M. Endothelial cells recruit macrophages and contribute to a fibrotic milieu in bleomycin lung injury. Am. J. Respir. Cell Mol. Biol. [Internet]. 2013; 49(6):1093-1101. doi: https://doi.org/f5j3qg DOI: https://doi.org/10.1165/rcmb.2013-0152OC
Derechos de autor 2025 Erdem Gülersoy, Canberk Balıkçı, İsmail Günal, Adem Şahan, Esma Kısmet

Esta obra está bajo licencia internacional Creative Commons Reconocimiento-NoComercial-CompartirIgual 4.0.


















